|
Redacción. Madrid
El ritmo de aprobaciones de nuevos medicamentos parece estar recuperando el brío de antaño. Pasada la época de los ‘blockbusters’, la industria farmacéutica ha atravesado un periodo de transición en el que diversos fracasos en la I+D lanzaron un jarro de agua fría a las aspiraciones de los laboratorios.
Tras un replanteamiento del enfoque, el paso al ‘nichebuster’ (aquella molécula de éxito para una pequeña clase de pacientes pero para la que la falta del alternativas terapéuticas convierte en esencial), a la medicina personalizada y al interés por los medicamentos huérfanos está dando un nuevo brío a la industria farmacéutica, que aunque lejos de las cifras de mediados de la década pasada, parece empezar a superar el bache de los últimos años y a recuperar el ritmo de lanzamientos de nuevos medicamentos.
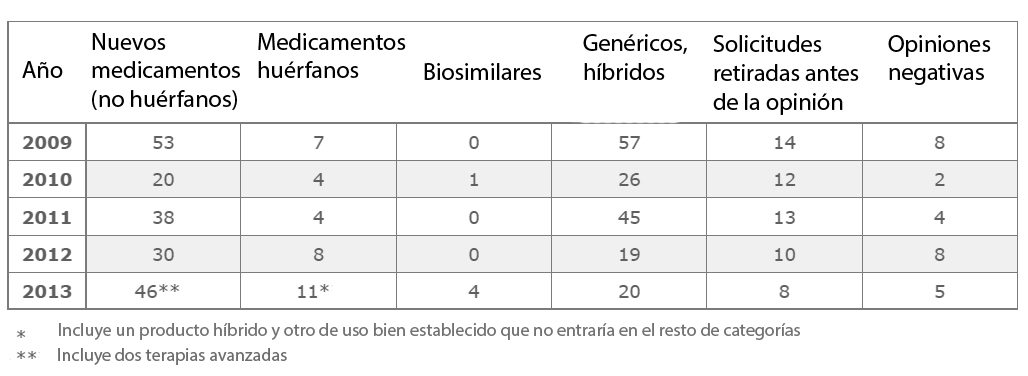
Tabla resumen de autorizaciones en Europa. Fuente: Agencia Europea del Medicamento.
|
La Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha publicado las cifras sobre los dictámenes que su Comité de Medicamentos de Uso Humano (CHMP, también en acrónimo anglosajón) emitió el año pasado. Así, 81 solicitudes de comercialización recibieron su respaldo (la autorización la da la Comisión Europea y lo normal es que haga caso de la Agencia), 24 más que en 2012.
De las 81 aprobaciones, 38 correspondieron a medicamentos que contenían nuevos principios activos, por 35 de 2012, 25 de 2011 y 15 de 2010. También se aprobaron 11 medicamentos huérfanos, frente a los 8 del año pasado y a 4 de los dos anteriores, lo que indica una clara tendencia de la industria a dirigir su atención hacia las inmensas necesidades por cubrir de las enfermedades raras.
La cada vez mayor presencia de innovaciones respecto a los últimos años se mezcla con otra tendencia, la del cada vez menor peso de los genéricos en las cifras totales (en parte debido a que muchas compañías han acabado optando por las solicitudes nacionales en lugar de la centralizada), que se ha reducido hasta la mitad de otros años. En cambio, 2013 fue un buen año para los biosimilares: cuatro fueron aprobados, incluyendo los dos primeros anticuerpos monoclonales de la categoría. En los últimos cinco años solo se había aprobado un biosimilar, lo que da idea del interés que han recobrado tras las primeras expiraciones de anticuerpos monoclonales.

Aprobaciones de medicamentos huérfanos. Fuente: Agencia Europea del Medicamento.
|
‘Boom’ de los tratamientos personalizados en cáncer
Por áreas terapéuticas, el mayor número de opiniones positivas del CHMP corresponde a fármacos oncológicos: 16 fueron aprobados en 2013, y 12 de ellos eran innovaciones. La mayoría están dirigidos a terapias personalizadas. La EMA también destaca los 5 fármacos aprobados para diabetes tipo 2 (cuatro de ellos, nuevos principios activos), 4 para VIH y 3 para tuberculosis multirresistente, indicación huérfana asociada con una tasa de mortalidad muy alta.
En el viraje de la industria farmacéutica hacia el nicho y las necesidades no cubiertas destaca también el número de medicamentos que se han incorporado al vademécum a través de caminos regulatorios especiales, debido a que se trata de patologías tan extrañas que no se pueden proporcionar datos exhaustivos para su autorización. La Agencia Europea concedió la aprobación bajo circunstancias excepcionales a 9 fármacos; entre ellos, agentes anticancerígenos, moléculas para enfermedades raras y una vacuna contra la viruela. A ellos hay que añadir la inclusión de dos moléculas para el virus de la hepatitis C que han entrado en uso compasivo.
La EMA también destaca que la mitad de las solicitudes recibieron asesoramiento científico por parte del CHMP, algo que se tradujo en un 90 por ciento de posibilidades de recibir una opinión positiva. En cambio, aquellos que no pidieron este tipo de asesoramiento solo tuvieron un 30 por ciento de probabilidad de tener el visto bueno.
En el apartado negativo, en 2013 fueron 7 las solicitudes rechazadas, de las que 2 se transformaron en opinión positiva tras un reexamen. 8 solicitudes fueron retiradas por los solicitantes antes de recibir un dictamen del CHMP.
|